Příběh dvouletého Martina s AADC syndromem, což je vzácné genetické onemocnění, zveřejnila jeho rodina na platformě Donio. Jejím prostřednictvím chtěla vybrat peníze na zahraniční léčbu. Ta totiž existuje, ale je velmi nákladná a v Česku zatím není dostupná ani hrazená z veřejného zdravotního pojištění. Podle rodiny jen léčivý přípravek vyjde na 100 milionů korun.
Co se dozvíte v článku
Sumu rodině dárci poslali. Peníze se sešly ani ne za měsíc a částky rychle naskakovaly zejména v posledních dnech, kdy sbírku podpořily známé osobnosti. Výší sbírky a rychlostí, s jakou finanční prostředky dárci shromáždili, jde o tuzemský unikát. Blízcí malého pacienta i jeho ošetřující lékaři nyní řeší to, aby chlapec léčbu dostal co nejdříve. Kde podání terapie proběhne, zatím není podle serveru iDNES.cz jasné.
Pro koho je terapie určena
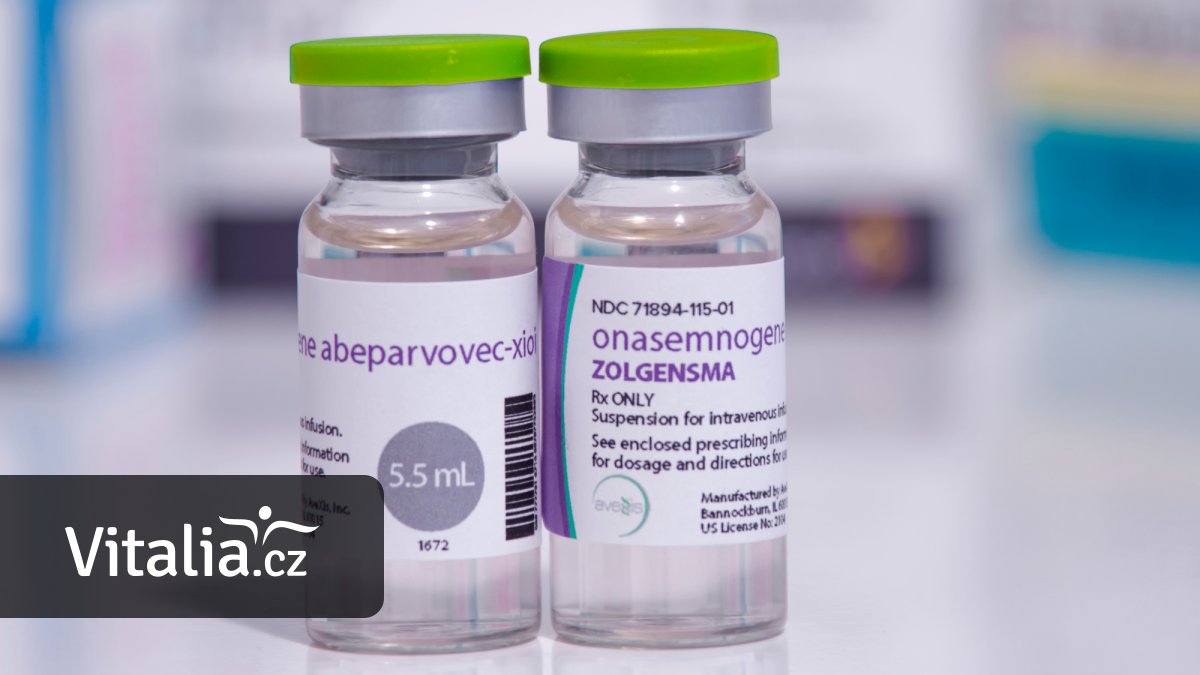
Léčivý přípravek, na nějž se dárci skládali, se nazývá Upstaza. Jde o novinku patřící mezi takzvanou systémovou genovou léčbu. Respektive je prvním lékem systémové genové léčby podávaným přímo do mozku pacienta.
Upstazu vyrábí americká biotechnologická společnost PTC Therapeutics. První pacient ji dostal v roce 2010.
Účinnou látkou je eladokagen exuparvovek. Přípravek je určený k léčbě dětí od 18 měsíců a dospělých, kteří mají diagnostikovaný syndrom AADC.
Příčinou onemocnění je nedostatečná tvorba enzymu AADC, který je klíčový pro přeměnu aminokyselin (dopaminu a serotoninu) na odpovídající neurotransmitery. Ty jsou nezbytné pro správnou komunikaci mezi nervovými buňkami.
Syndrom AADC sice nová terapie léčí, dosud je ale považován za nevyléčitelný. Potíže způsobené tímto onemocněním jsou takového charakteru, že pacienti se ovšem bez léčby nedožijí dospělosti. Nejčastěji umírají mezi pátým a sedmým rokem života.
Jakou má léčba podobu
Léčivo má podobu infuzního roztoku, který do nemocnice putuje ve zmrazeném stavu a uchovává se při teplotách nižších než −65 ºC. Před podáním je proto nutné jej v nemocniční lékárně připravit tak, aby do rukou lékařů šel opět ve formě roztoku. Jak výrobce podotýká, dávka léčiva je pro každého pacienta stejná, individuálně se neupravuje.
Upstaza pro jednoho pacienta se skládá ze čtyř infuzí. Ty jsou v celkové anestezii naráz aplikovány do mozku (vždy dvě infuze do každé hemisféry). Cílí na oblast nazývanou putamen.
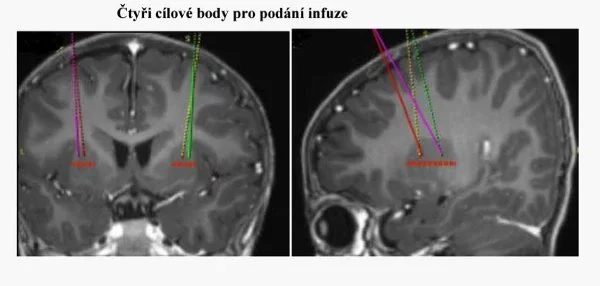
Terapie Upstaza se skládá ze čtyř infuzí. Na snímku jsou vidět místa, kam je nutné zavést kanyly kvůli jejich podání. Infuze se podávají všechny najednou a vyžadují miniinvazivní zákrok neurochirurga.
Podání přípravku se proto neobejde bez přítomnosti neurochirurga a terapie může proběhnout jen v nemocnici, kde mají zázemí pro tzv. stereotaktickou neurochirurgii. Zákrok, který je nutný kvůli léčbě provést, patří k miniinvazivním. Jde o navrtání dvou otvorů do lebky. Podobá se zákroku předcházejícímu hluboké mozkové stimulaci při léčbě Parkinsonovy choroby.
Přispíváte na sbírky na léčbu a podobně?
Po léčbě následuje hospitalizace a série kontrol včetně dlouhodobého sledování zdravotního stavu. Nejspíš celoživotního. Zda je nutné terapii někdy za život pacienta opakovat, zatím není jasné.
Cílem Upstazy je napravit to, co způsobila mutace jednoho z genů. Při terapii se proto do organismu pacienta dostává funkční verze genu AADC, a to s pomocí tzv. virového vektoru, chcete-li nosiče. Jde o adenovir, jenž je v laboratoři upraven tak, aby nevyvolal onemocnění a stal se nositelem chybějící bílkoviny. Pokud je tato bílkovina s pomocí nosiče dopravena do buněk nervového systému, doživotně v nich zůstává, protože tyto buňky se nedělí.
„Při podání pacientovi infuzí do mozku se očekává, že virus přenese gen AADC do nervových buněk, což jim umožní produkovat chybějící enzym. Očekává se, že to umožní buňkám produkovat látky, jež potřebují ke správnému fungování (jako je dopamin a serotonin), čímž se zlepší symptomy onemocnění,“ uvádí Evropská agentura pro léčivé přípravky (EMA) v tiskové zprávě z konce loňského května. „Tato jednorázová léčba (…) podporuje produkci klíčových neurotransmiterů,“ uvádí na webu společnost PTC Therapeutics.
Efekt léčby terapií Upstaza
V souhrnu údajů o přípravku, jenž je na webu EMA dostupný také v českém jazyce, je napsáno, že terapie prošla třemi klinickými studiemi. V nich byla podána 28 dětem ve věku od 19 měsíců do 8,5 let. Všechny měly diagnostikovaný syndrom AADC.
Po podání čtyři infuzí byli tito pacienti v rámci studie i nadále sledováni, a to kvůli možným nežádoucím účinkům a také efektu léčby. Minimální doba byla něco málo přes tři měsíce, maximální doba sledování činila necelých deset let.
Podle webu AADCnews.com měli všichni pacienti po pěti letech od podání terapie trvalou produkci dopaminu, zlepšili svou schopnost sedět, chodit a mluvit a nevyskytlo se u nich nic, co by narušilo předpoklad, že léčivý přípravek Upstaza je pro pacienty bezpečný.
Jak shrnuje závěry EMA, jež zodpovídá za hodnocení a dohled nad léčivými přípravky v EU, studie prokázaly, že přípravek Upstaza u pacientů zlepšuje schopnost pohybovat hlavou či sedět bez pomoci. V klinických studiích zlepšení vykazovala většina pacientů. Třetina zvládla také stání s oporou, desetina chůzi s oporou. Bez léku by toho nebyli schopni. „Na začátku léčby tito pacienti vykazovali nulový motorický vývoj, kdy schopnost sedět, stát nebo chodit odpovídaly závažnému fenotypu při onemocnění,“ uvádí souhrn údajů o přípravku.
Průvodní dokumenty k léčivu uvádějí, že rychleji léčba přináší efekt u pacientů, kteří eladokagen exuparvovek dostanou v mladším věku.
Nežádoucí účinky léčby
Novinka sice představuje první lék cílený přímo na syndrom AADC, není ale bez rizik. Ta se odvíjejí od samotné operace mozku, u níž je klíčové, aby neurochirurg zavedl kanyly na přesně určená místa.
Při operaci je rizikem například únik mozkomíšního moku, chudokrevnost nebo infekce. Po zákroku se uvádějí nežádoucí účinky v podobě zápalu plic, nízkého tlaku, poruchy rytmu srdce, krvácení do trávicího traktu nebo horečky.
Zdravotní rizika jsou spojena i se samotným podáním terapie. Velmi častým nežádoucím účinkem jsou u pacientů potíže s usínáním a podrážděnost. U 24 z 28 pacientů se v klinické studii objevil nárůst nekontrolovatelných a mimovolních pohybů, tedy tzv. dyskineze.
„Nejčastějším nežádoucím účinkem byla dyskineze, která byla hlášena u 24 (85,7 %) pacientů a vyskytovala se převážně během prvních dvou měsíců po léčbě,“ uvádí souhrn údajů o přípravku. „Zvýšení dyskineze způsobené touto dopaminovou senzitivitou začíná obvykle jeden měsíc po podání genové terapie a postupně se během několika měsíců snižuje. Ke zvládání příznaků dyskineze lze zvážit podávání antagonistů dopaminu (risperidonu),“ dodává průvodní dokument léčivého přípravku.
Konkrétně souhrn údajů zmiňuje, že z 35 příhod dyskineze jich bylo 33 mírných až středně závažných a dvě příhody byly závažné. Většina příhod odezněla přibližně do dvou měsíců a všechny odezněly nejpozději do sedmi měsíců.
Další jiné potíže nejsou zmiňovány a podle veřejně dostupných zdrojů žádné nežádoucí účinky související s léčbou nevedly k hospitalizaci nebo úmrtí. Výrobce ale zdůrazňuje, že zdravotní stav pacienta musí být velmi důsledně sledován a případné nežádoucí účinky hlášeny.
Závěr ale je, že projevy nežádoucích účinků nepřevažují nad benefity, které z léčby malý pacient získá. „Přestože jsou údaje o bezpečnosti přípravku Upstaza omezené, dosud pozorované nežádoucí účinky jsou považovány za zvládnutelné. Evropská agentura pro léčivé přípravky rozhodla, že přínosy přípravku Upstaza převyšují jeho rizika a může být registrován k použití v EU,“ zdůvodňuje registraci léčiva EMA.
Má registraci, v Česku ale není
Rozhodnutí o registraci platné v celé EU získala Upstaza 18. července 2022, přičemž EMA na svém webu uvádí, že bylo uděleno v mimořádném režimu. „Vzhledem k tomu, že se s indikací (tj. syndromem AADC, pozn. red.) setkáváme zřídka, nebylo možné získat o léčivém přípravku úplné informace,“ uvádí se na webu EMA.
V jedné z tiskových zpráv EMA uvádí, že registrace za výjimečných okolností umožňuje pacientům dostat se k lékům, jež nelze schválit standardní cestou registrace. „Protože za normálních podmínek použití nelze získat komplexní údaje, a to buď proto, že existuje jen velmi málo pacientů s tímto onemocněním, sběr úplných informací o účinnosti a bezpečnosti léku by byl neetický, nebo existují mezery ve vědeckých poznatcích,“ uvádí EMA.
Mimořádný režim znamená, že léčivý přípravek je pod větším drobnohledem než jiná léčiva, jež si prošla běžnou registrací. Výrobce, kterým je americká biotechnologická společnost PTC Therapeutics, musí i nadále lékové autoritě předkládat řadu dokumentů a výsledků dosavadní léčby, protože EMA bude každoročně vyhodnocovat přínosy a rizika Upstazy. Léčivo čeká také další klinické testování.
Ačkoliv Upstaza má celoevropskou registraci a používat se smí také ve Velké Británii, v České republice zatím dostupná není. „Je to proto, že pro její podání je nutné mít akreditované pracoviště. A tato akreditace nějakou dobu trvá, takže ji zatím nemáme,“ říká pro Vitalia.cz neuroložka Jana Haberlová, jež je ošetřující lékařkou Martina a která pracuje ve Fakultní nemocnici Motol. Právě v Motole podávali vůbec první dávku systémové genové terapie u nás. Šlo o infuzi léčivého přípravku Zolgensma určenou malým pacientům se spinální svalovou atrofií. Právě na toto onemocnění se i v Česku používá jiné léčivo, které zmiňuje PTC Therapeutics na svém webu. Jde o roztok k užívání ústy nazvaný Evrysdi. PTC Therapeutics uvádí, že s držitelem rozhodnutí o registraci spolupracovala na programu léčby spinální svalové atrofie.
Proč vzniká syndrom AADC
Syndrom AADC je dědičné genetické onemocnění, které postihuje nervový systém. Řadí se mezi velmi vzácné nemoci, neboť jak uvádí Martinova rodina, na světě s touto diagnózou žije asi jen 120 dětí.
Příčinou je mutace genu označovaného zkratkou DDC. Ta vede ke snížení či absenci enzymu AADC, jenž přeměňuje látku nazývanou levodopa na dopamin. Pokud enzym AADC funguje málo či vůbec, tělo si nevytváří dopaminu dostatek. Pro malé pacienty to znamená, že zaostávají ve vývoji. „Většina pacientů s deficitem AADC nedosahuje vývojových milníků,“ konstatuje průvodní dokument k přípravku Upstaza.
Syndrom se projevuje celou řadou různorodých příznaků, a to již v kojeneckém věku. Výrobce terapie uvádí, že mnohé z potíží jsou zaznamenány již kolem desátého měsíce života dítěte.
Příznaky onemocnění
- Špatný svalový tonus, ochablost svalů,
- opožděný vývoj při držení hlavy a jejích pohybech, při plazení, řeči a v dalších oblastech,
- poruchy hybnosti – např. dystonie (záškuby) nebo hypokineze (chudost a zmenšený rozsah pohybů),
- mimovolní pohyby očí,
- abnormálně nadměrné pocení,
- nadměrné slinění,
- povislá víčka,
- gastrointestinální problémy, jako je reflux, průjem nebo zácpa,
- problémy s chováním.
Zdroj: PTC Therapeutics